Cart (0 Items)
Your cart is currently empty.
View ProductsNous savons que l’humanisation d’anticorps est l’une des étapes les plus cruciales sur la voie des essais cliniques (IND). C’est pourquoi nos experts font partie des plus grands scientifiques du secteur, affichant un parcours d’excellence. Nous comptons actuellement 3 anticorps thérapeutiques déjà commercialisés et plus de 30 en phases précliniques et cliniques. Nous considérons chaque nouveau projet d’humanisation d’anticorps monoclonaux comme un défi unique et passionnant pour amener votre molécule en clinique.
Experts reconnus en humanisation d’anticorps
Accédez à des spécialistes avec plus de 25 ans d’expérience et un parcours inégalé dans le service d’humanisation d’anticorps monoclonaux.
Modélisation 3D
Notre plateforme de modélisation 3D garantit la conservation des fonctions biologiques.
Sans contrainte de propriété intellectuelle
Vous bénéficiez d’une pleine propriété sur les anticorps humanisés.
Panel complet de caractérisations
ELISA, détermination du KD contre antigène soluble ou cellules, thermostabilité, taux d’agrégation, IC50…
XtenCHOTM
Bénéficiez du système d’expression transitoire le plus performant pour produire toutes vos variantes d’anticorps monoclonaux humanisés !
Diversité de formats
Nous optimisons et humanisons tous les formats : IgG entier, scFv, Fab, VHH (nanocorps)…
Séquençage d’anticorps à partir d’une lignée hybride
Évaluation de la bioactivité de l’anticorps chimérique
Conception de l’anticorps monoclonal humanisé
Production d’anticorps humanisés (9 à 18 variantes)
Caractérisation des variantes humanisées
| Étape | Contenu | Délais | Livrables |
|---|---|---|---|
| Séquençage de l’anticorps parental depuis l’hybridome |
|
~2-3 semaines |
|
| Expression et purification d’anticorps chimérique |
|
2-3 semaines |
|
| Conception de l’anticorps humanisé |
|
~2 semaines |
|
| Production recombinante transitoire de 9 à 18 variantes d’anticorps humanisé |
|
2-3 semaines |
|
| Caractérisation des variantes humanisées d’anticorps monoclonal |
|
À déterminer |
|
Options disponibles :
L’objectif principal de l’humanisation est d’obtenir une séquence conforme aux recommandations de l’Organisation Mondiale de la Santé (OMS/WHO) pour les anticorps humanisés. En général, un anticorps est considéré humanisé quand la similarité de séquence avec une lignée germinale humaine (base de données IMGT) est d’au moins 85 %. La différence entre anticorps humanisé et anticorps entièrement humain dépend de l’origine de l’anticorps : les anticorps issus d’espèces non humaines sont classés comme humanisés après l’humanisation, pendant que les séquences d’origine humaine sont considérées comme « fully human antibodies » (anticorps entièrement humains).
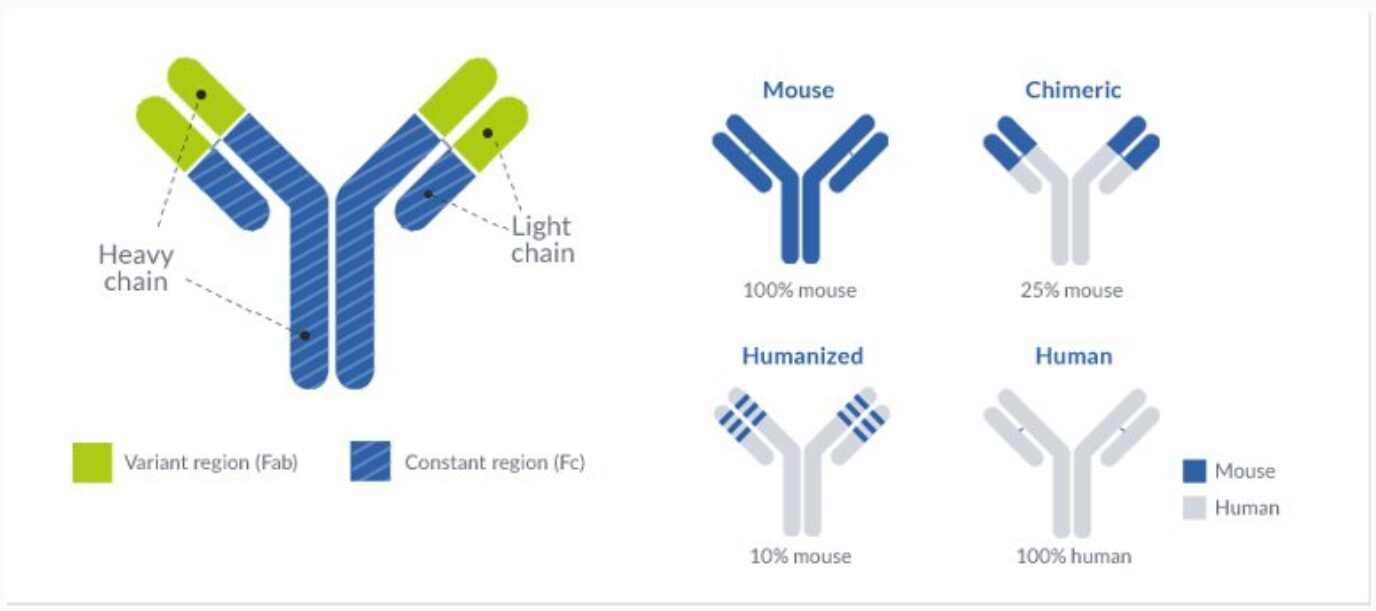
Atteindre cet objectif de 85 % requiert de modifier la séquence d’anticorps dans les régions variables. Ce travail d’ingénierie sur l’anticorps peut donc impacter de manière critique les propriétés physico-chimiques et pharmacologiques du produit final et doit être réalisé avec la plus grande attention. Pour cette raison, ProteoGenix associe un savoir-faire inégalé en conception d’anticorps à des experts forts de plus de 25 ans d’expérience et d’un solide parcours en humanisation d’anticorps. Notre service d’humanisation d’anticorps monoclonaux repose sur le CDR-grafting, la modélisation moléculaire 3D et l’optimisation de séquence.
La modélisation moléculaire 3D est une étape essentielle, car elle permet d’analyser la contribution de chaque acide aminé localisé dans les boucles CDR murines et dans les régions charpentes. Elle est indispensable pour repérer les résidus à rétromuter et ceux pouvant être modifiés pour optimiser les propriétés ultérieures. Les acides aminés des régions variables sont classés ainsi :
Les résidus des charpentes murines jugés essentiels au maintien de la conformation des CDR et de la bioactivité sont rétromutés dans les lignées humaines sélectionnées.
Le choix des lignées germinales humaines repose sur l’homologie de séquence, mais d’autres variantes, offrant parfois une homologie plus faible mais de meilleures propriétés, peuvent aussi être explorées. Lors d’un projet d’humanisation, ProteoGenix sélectionne plusieurs chaînes lourdes et légères afin de générer entre 9 et 18 combinaisons.
Les anticorps générés sont ensuite caractérisés et comparés à l’anticorps parental et/ou chimérique de référence pour évaluer leur :
Après validation, les candidats principaux peuvent être sélectionnés pour une humanisation ou une optimisation supplémentaire des séquences CDR pour améliorer les propriétés biophysiques (hétérogénéité, fragmentation, agrégation…) et la fabricabilité (bioproduction).
Une maturation d’affinité complète par phage display peut aussi être réalisée via des banques aléatoires ou dirigées.
Les anticorps monoclonaux murins furent les premiers produits in vitro. Toutefois, leur évaluation clinique a révélé très tôt des effets indésirables – une réponse allergique modérée nommée « réponse HAMA » (anti-murine). Cette découverte a poussé au développement de techniques d’humanisation désormais essentielles pour le développement d’anticorps thérapeutiques d’origine non humaine.
En février 2020, 82 anticorps thérapeutiques étaient autorisés (FDA ou EMA) aux USA ou dans l’UE. Parmi eux, 39 sont des immunoglobulines humanisées issues de la souris ou du lapin. Cela reflète les avancées récentes du service d’humanisation d’anticorps monoclonaux. De plus, cela prouve que les anticorps humanisés restent aussi efficaces que les anticorps entièrement humains pour l’approbation clinique.
Au fil des années, différents procédés d’humanisation ont été développés. Beaucoup s’appliquent aux anticorps quel que soit l’hôte d’origine, si bien que les méthodes d’humanisation sont appelées à s’élargir à d’autres espèces (lapin, camelidés…).
Les immunoglobulines comprennent quatre chaînes – deux lourdes (H) et deux légères (L), identiques entre elles. Chaque chaîne contient un domaine variable (V) et un domaine constant (C), responsables respectivement de l’interaction avec l’antigène ou d’éléments clés du système immunitaire. Dans chaque domaine V (VL et VH), trois boucles CDR (complementarity-determining regions) ou régions hypervariables forment les sites de contact avec l’antigène.
Ainsi, les CDR et régions adjacentes contiennent l’information essentielle à la spécificité antigénique. Ce fait a permis de développer la méthode la plus populaire d’humanisation – le CDR-grafting – qui transplante ces régions dans la charpente d’un anticorps humain, réduisant le risque d’immunogénicité.
La plupart des stratégies débutent par la création d’un anticorps chimérique IgG comportant le domaine V de la molécule xénogénique et le C d’une IgG humaine classique. Après obtention d’une molécule chimérique stable, les efforts d’humanisation se concentrent sur la région variable.
Jusqu’à aujourd’hui, le CDR-grafting demeure la méthode privilégiée pour le service d’humanisation d’anticorps monoclonaux. Cette technique requiert un « donneur » contenant les CDR et un « accepteur » humain qui servira de charpente à la molécule hybride. La clé est le choix du « bon accepteur ».
En général, on sélectionne les charpentes humaines ayant la plus grande homologie avec la région correspondante de l’anticorps xénogénique.
Pourtant, les premiers essais de CDR-grafting sur anticorps murins ont mené à une perte marquée d’affinité/spécificité, due à l’annotation approximative des régions CDR, au choix d’une mauvaise charpente humaine ou à une identification erronée des régions homologues entre « donneur » et « accepteur ».
Très vite, il s’est avéré que greffer uniquement les CDR était insuffisant, car des résidus contigus pouvaient aussi influencer le site de liaison à l’antigène. Ces régions clés, situées près des boucles CDR, sont dites « zones Vernier ». Elles influent sur la stabilité et la structure des CDR, donc sur l’affinité et la spécificité. Les protocoles récents de CDR-grafting incluent donc également ces régions complémentaires.
D’autres chercheurs adoptent une logique opposée pour apparier « accepteur » et « donneur ». Plutôt que de s’appuyer sur l’homologie des régions charpentes FWR, ils recherchent l’appariement entre CDR. Pourquoi ? À cause de l’impact des résidus adjacents sur la structure des anticorps.
Contrairement à la méthode classique, l’humanisation par homologie de CDR ne conserve pas les résidus de la zone Vernier, mais cherche un anticorps IgG humain existant à l’organisation structurelle similaire. On observe ainsi le maintien d’une meilleure affinité comparée à la méthode fondée sur l’homologie FWR.
Ces résultats laissent penser que cette alternative est prometteuse pour le service d’humanisation d’anticorps monoclonaux. Pourtant, cette approche n’est pas aussi adoptée que la précédente pour le développement thérapeutique, possiblement car elle a émergé plus tardivement.
Des anticorps issus du CDR-grafting peuvent encore provoquer une réponse immunitaire. Pour limiter celle-ci, les régions greffées peuvent être restreintes aux SDR (specificity-determining residues).
Les SDR représentent les résidus les plus impliqués dans l’interaction avec l’antigène au sein des CDR. En ne transférant que ces résidus, au lieu de l’ensemble des CDR, on vise à réduire la réponse anti-idiotypique (anti-Id). Plusieurs études sur les anticorps murins montrent un maintien de l’affinité et une immunogénicité réduite.
Le SDR-grafting suit les mêmes principes que le CDR-grafting par homologie FWR en matière de choix de charpentes humaines et d’annotation CDR correcte. Cependant, peu d’études existent récemment, ce qui suggère que cette technique reste marginale.
La « resurfacing » des domaines variables a émergé dans les années 1990. Contrairement au CDR ou SDR-grafting, cette méthode adopte une approche globale.
Au lieu de cibler des régions particulières, le resurfacing identifie les résidus de surface susceptibles d’induire une réponse immunitaire, et les remplace par ceux prédominant chez l’être humain au même emplacement. Il s’agit donc de substituer les résidus problématiques des régions charpentes xénogéniques par des résidus communs aux anticorps humains.
Plusieurs études montrent que les anticorps humanisés par resurfacing présentent une meilleure durée de vie, une immunogénicité réduite et une activité in vitro comparable. Mais peu d’anticorps ont suivi cette voie : davantage de données sont nécessaires pour en confirmer le potentiel.
Parmi toutes les méthodes actuelles, l’humanisation basée sur les lignées germinales est la plus innovante – mais controversée. L’idée est que les charpentes humaines germinales sont mieux tolérées par le système immunitaire que celles issues d’anticorps IgG arrivés à maturité. Contrairement aux séquences germinales (avant maturation d’affinité), les charpentes IgG subissent de nombreuses hypermutations somatiques lors de la maturation d’affinité. Même les molécules IgG entièrement humaines peuvent déclencher une réaction immunitaire : la réponse « HAHA » (human anti-human antibody).
Certaines études rapportent la conservation de l’efficacité thérapeutique malgré cette stratégie, d’autres non. Des recherches complémentaires sont donc nécessaires pour en comprendre le vrai potentiel.
Une question ou besoin d’un devis ? Envoyez-nous un message, réponse sous 48h.